The Laboratory for Functional Glycomics

糖蛋白/糖结合蛋白分离技术
样本的收集在糖组学研究中是繁琐而必须的,目前常见的应用技术主要包括了基于凝集素磁性微粒复合物的糖蛋白及其糖链的分离纯化技术,滤膜辅助凝集素分离糖肽及其糖基化位点分析技术,酰肼化学法糖蛋白/糖肽分离纯化技术及其糖基化位点分析技术,亲水亲和分离纯化糖蛋白技术,以及滤膜辅助糖蛋白糖链技术。
一 凝集素磁性微粒复合物的糖蛋白及糖链分离技术
该技术主要用于分离生物样品中的糖蛋白,并对其蛋白和糖链结构进行鉴定和解析。基于凝集素磁性微粒分离纯化糖蛋白技术具有与多种凝集素兼容,便于操作和对糖蛋白糖链的特异性识别并保护糖链结构不受破坏的优势,被广泛地应用到糖蛋白质组学的研究。其基本原理是利用固定化于磁性微粒上的凝集素与生物样品中的糖蛋白特异性的识别并结合,然后通过不同的洗脱的方法对糖蛋白亚组分进行分离。基于凝集素磁性微粒的糖蛋白分离纯化技术主要分为三大步:凝集素磁性微粒复合物的制备;糖蛋白及其糖链的分离纯化;糖蛋白及其糖链结构的鉴定和解析。
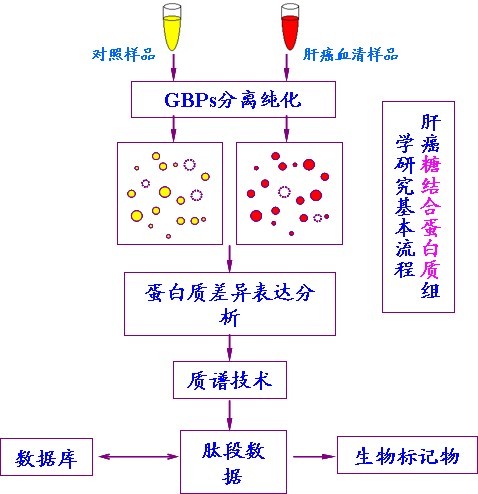
本实验室以磁性微粒作为固相载体,利用凝集素与糖链特异性结合的性质分离纯化各种样品中的糖蛋白质,得到的糖蛋白经MALDI-TOF-MS和LC-ESI-MS鉴定,得出其糖链和蛋白结构。该方法被应用于分离纯化正常人血清和肝细胞癌病人血清中的糖蛋白,进而寻找两者的差异糖蛋白及糖链修饰。鉴定的糖蛋白利用Blast2go软件进行注释,解释其在肝细胞癌发生发展过程中的作用。
(2005年已申请发明专利,申请号:200510096271.2;公开号:CN1958600;)
二 滤膜辅助凝集素分离糖肽及其糖基化位点分析技术
糖基化作为最重要蛋白质翻译后修饰之一,影响着蛋白质结构,稳定性,以及生物功能,特别是糖基化位点变化会严重改变糖蛋白的空间结构和构象,因此糖基化位点的鉴定是糖蛋白质研究中不可或缺的部分。现在质谱技术在分析糖蛋白方面发挥着巨大的作用,特别是在分析糖基化位点方面优势更为突出。为了更好地鉴定糖基化位点去糖基化酶(如 PNGaseF酶)被广泛应用,利用这种去糖基化酶可以使天冬酰胺脱氨基生成天冬氨酸,释放糖链并有一个 0.9848 的相对分子质量转换,这个相对分子质量的变化可以通过串联质谱的鉴定而得以发现,从而可以确定糖基化位点。本技术首先是将蛋白质在 30k 的滤膜上进行胰蛋白酶酶解,利用分子筛效应,通过离心收集酶解的多肽(包括糖肽和非糖肽);然后将收集的多肽转移至新的滤膜中,糖肽通过糖链结构特异性与滤膜上的凝集素结合,使其保留在滤膜上,然后通过离心去除没有结合的多肽;最后用糖肽酶 PNGaseF 酶解释放糖肽上的多肽,通过离心收集获得去除糖链的糖肽,最后应用液相色谱 - 质谱联用技术鉴定并分析糖肽的糖基化位点。
三 酰肼化学法糖蛋白/糖肽分离纯化技术及其糖基化位点分析技术
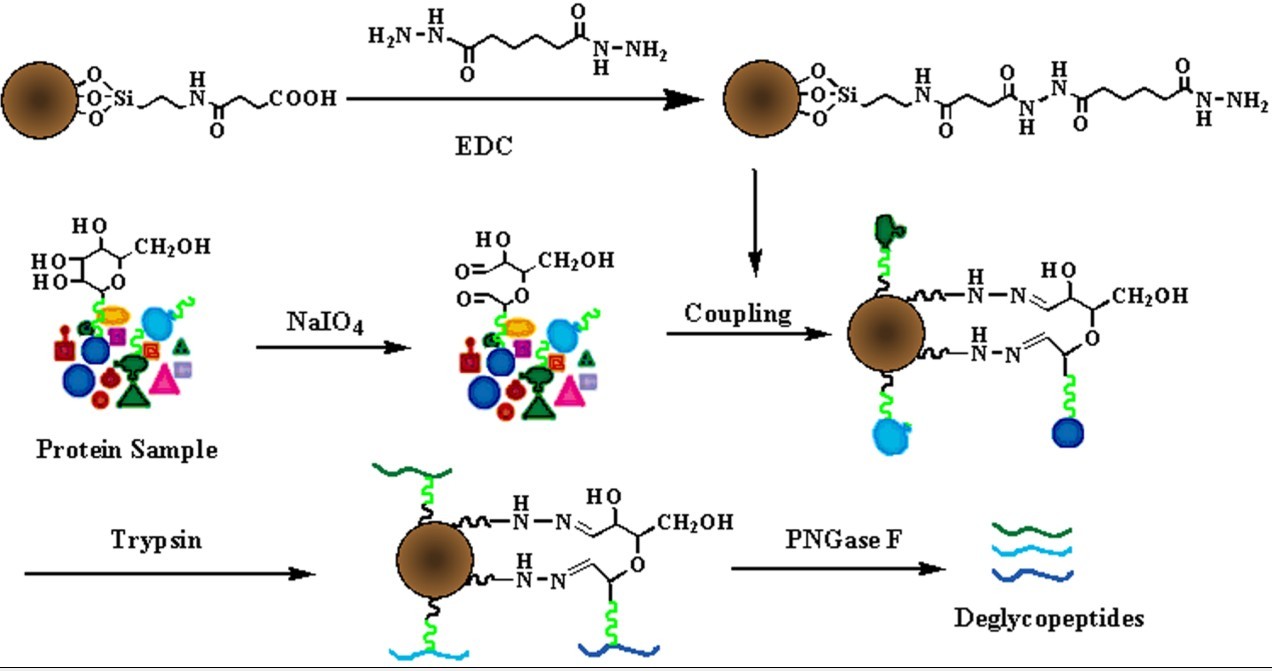
糖蛋白糖链上的邻-顺二羟基经高碘酸氧化变为醛基,醛基可以特异地与酰肼树脂(或酰肼磁粒)上的酰肼基团共价结合,清洗除去未结合或非共价结合到树脂上的蛋白,糖蛋白在树脂上得到富集。树脂上的N-糖蛋白可使用PNGaseF(或其他糖链内切酶和化学方法)直接从树脂上释放,之后对提取到的糖蛋白进行进一步分析;也可首先通过胰蛋白酶酶解(或其他蛋白内切酶),然后再次清洗除去糖蛋白的非糖基化多肽,最后使用 PNGaseF从树脂上仅释放N-糖基化多肽,便于对糖蛋白N- 糖肽部分的分析和糖基化位点的鉴定。本技术可以一次性不选择地富集不同类型的糖蛋白/糖肽,然后使用不同方法依次洗脱,比如用 PNGaseF 酶法释放N-糖蛋白/糖肽, β-消除法释放O-糖蛋白/糖肽,且由于糖肽和树脂之间的共价结合较紧密,可以通过较剧烈的方式清洗树脂以更好的减少非特异性结合,因而该方法特异性较好。酰肼化学提取 N-糖肽方法又可分为三种不同的提取途径: N-糖蛋白提取途径, N-糖肽提取途径和末端唾液酸化N-糖肽提取途径。
肼功能化磁粒分离纯化N-糖肽示意图
Shisheng Sun, Ganglong Yang, Ting Wang, Qinzhe Wang, Chao Chen, Zheng Li. Isolation of N-linked glycopeptides by hydrazine-functionalized magnetic particles. Analytical and Bioanalytical Chemistry. 2010, 396(8): 3071-8.
蛋白N-糖基化位点发生在保守序列N-X-S/T (X可以是除脯氨酸外的任意氨基酸)中的天冬酰胺(N)上,但是并不是所有具有该保守序列的N上都会发生糖基化。糖基化位点鉴定不仅可以确定蛋白潜在N糖基化位点是否真实发生了糖基化,还可以通过数据库搜索鉴定该糖基化位点对应的糖蛋白,降低了糖蛋白鉴定中的样品复杂性。本实验室通过己二酸二酰肼活化羧基化磁粒,制备肼功能化磁性微粒;利用肼功能化磁性微粒分离纯化糖蛋白酶解液中的糖肽;然后通过PNGase F将发生糖基化的多肽部分从磁粒上释放;释放过程中糖基化位点出的天冬酰胺(N)转变为天冬氨酸(D),分子量增加0.98 Da,起到质量标记糖基化位点的作用;最后质谱鉴定去糖基化多肽。数据分析和数据库检索鉴定各蛋白糖基化位点和对应糖蛋白。
四 亲水亲和分离纯化糖蛋白技术
亲水亲和分离技术的特点是利用亲水的固定相和疏水的流动相,分离主要利用固定相与溶质之间的亲水作用完成。亲水的固定相可以富集缓冲液中的水分子从而在固定相表面形成一个水层,亲水的溶质在这个水层和疏水洗脱液中进行分配。在亲水亲和分离中,流动相是含有少量的水成物 / 极性溶剂的有机溶剂,有机组分是弱洗脱剂,水相是强洗脱剂。最后的分离是通过洗脱液与固定相之间的静电作用或与固定相形成氢键竞争亲水性溶质与固定相的结合位点,从而使溶质被洗脱下来。亲水亲和分离纯化糖蛋白技术利用糖链与固相基质间的亲水相互作用富集糖肽,对糖型无选择性,可同时富集 N-糖肽和 O- 糖肽,且操作简单,故在糖肽富集中得到了较广泛的应用。但亲水方法富集糖肽的特异性容易受到干扰,若非糖肽中含有较多亲水性氨基酸也可能通过亲水作用结合于固相载体表面得到富集。
五 滤膜辅助糖蛋白糖链的分离纯化
该技术主要用于生物样品中糖蛋白糖链的分离,并利用串联质谱技术分析其结构。其基本原理主要是利用糖蛋白与其糖链结构的相对分子质量差异,我们知道蛋白质的相对分子质量大于 10k,而目前鉴定到的 N- 连接糖链最多含有 28 个糖基,O- 连接糖链则更少,因此糖链相对分子质量一般不会超过 6k 。在 10K 超滤膜中糖蛋白的糖链通过酶解或者化学反应的方法从蛋白质中释放,然后通过合适的清洗液反复离心的方法可使糖链流出,而蛋白质仍保留于滤膜上,从而实现了糖链的分离。该技术的主要步骤是首先利用 10K 的滤膜除去样品中小分子物质,如游离的糖类物质。然后借助滤膜和PNGaseF酶释放样品中全糖蛋白的N- 连接糖链并与蛋白质分离;再借助滤膜采用 β-消除的方法分离样品中全糖蛋白的 O-连接糖链。
陕ICP备11008824号 Copyright ©2008-2020 the Laboratory for Functional Glycomic.
Taibai Bei Road, Xi'an, Shaanxi, China, +008613572067574 QQ 8135487.E-mail: cwt@nwu.edu.cn