The Laboratory for Functional Glycomics

流感病毒的糖基化
流感病毒是一种 RNA 负链病毒,属于正黏病毒科( Orthomyxoviras ),流感病毒属( Influenza virus genus )。通常流感病毒可以引发急性人呼吸道感染,并具有非常强的传染性和一定的死亡率,相比而言,由其他病毒或者细菌引起的普通感冒,通常致死局限于上呼吸道,并对人影响较小。
流感病毒基因组含有 8 条 RNA 链,并表达出 11 种以上蛋白,结构比较简单,研究程度较深。按照按照核蛋白和基质蛋白的抗原性,可以划分为 A,B,C 三种类型(国内称之甲,乙,丙),相应的 C 型流感病毒影响较温和,传播范围较小。 B 型只局限于人类宿主,变异较低,影响同样较小。但是 A 型病毒则具有广泛的生物学宿主,包括人类,水鸟与陆生禽鸟,猪,马,犬科以及猫科,甚至海豹以及鲸鱼等。而根据流感病毒表面囊膜的血凝素蛋白( Hemagglutinin, HA )和唾液酸酶蛋白( Neuraminidase, NA )的抗原特性, A 型流感病毒还可以划分为由 H1~H16 以及 N1~N10 组成的不同的亚型。
一 HA与NA蛋白全亚型糖基化位点的分布
【本文已发表于《PLoS One 》】
HA 是流感病毒囊膜纤突的主要成分之一,位于病毒粒囊膜外表面,成三聚体发挥功能作用,它也是是基因表达产物中最大的糖蛋白。 HA 在病毒识别吸附宿主“唾液酸 - 半乳糖”糖链末端结构以及介导病毒与宿主细胞膜融膜过程中起关键作用,为诱生保护性免疫的主要抗原刺激机体产生的中和抗体,可中和病毒的感染力,抵抗病毒的感染和发病。
NA 由病毒核糖核酸( vRNA )片段 6 编码,是位于流感病毒囊膜表面的另一个主要的糖蛋白,其成熟的形式是具有催化活性的蘑菇状四聚体,能将唾液酸从糖蛋白和糖脂的糖链末端中切离。按照 IUPAC 划分为 EC3.2.1.18 ,其作用是水解细胞表面甚至是自身 HA 和 NA 蛋白的糖链末端的 N- 乙酰神经氨酸,避免病毒粒子的聚集,有利于子代病毒的释放,从而造成病毒在感染细胞周围的大量扩散。 NA 蛋白同样具有抗原性,抗神经氨酸酶抗体可以抑制病毒从细胞中释放,但是并不起到抑制病毒的功能,目前国际上根据 NA 蛋白的抗原特性,将其划分为 N1~N10的10个亚型。
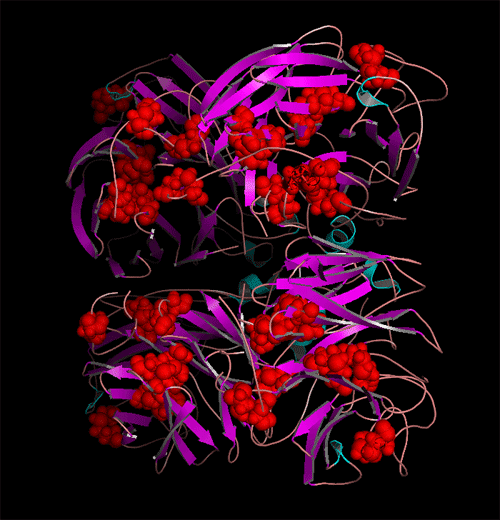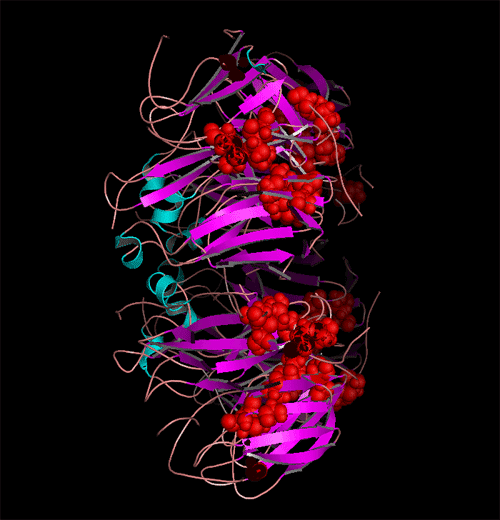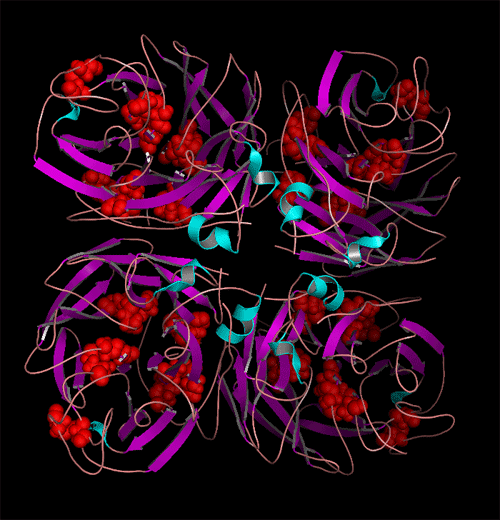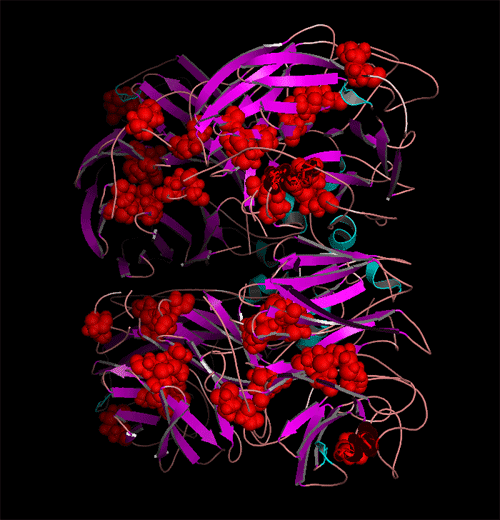
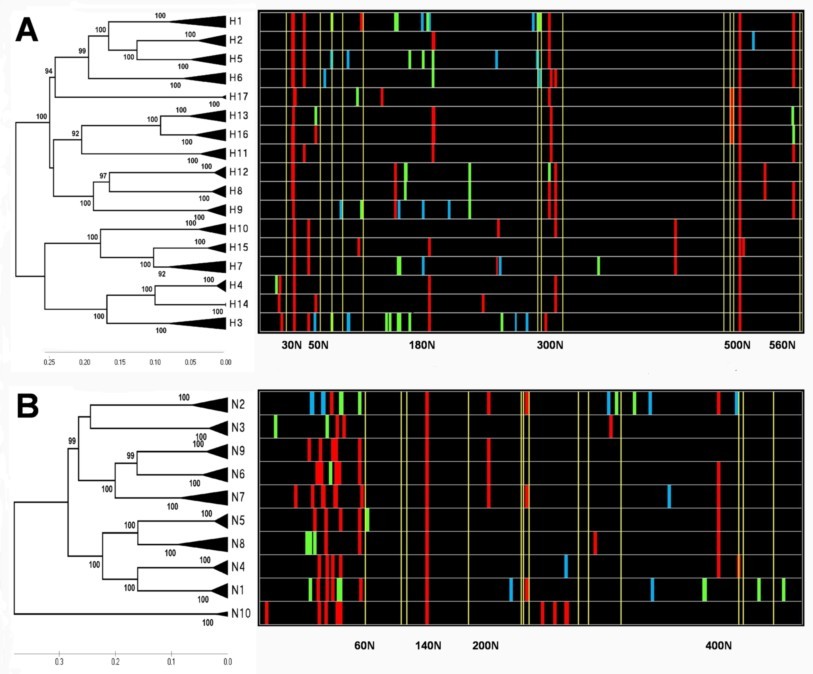
N-糖基化位点在HA与NA全亚型中分布图。(发表文章:Wentian Chen, Yaogang Zhong, Yannan Qin, Shisheng Sun, Zheng Li. (2012) The Evolutionary Pattern of Glycosylation Sites in Influenza Virus (H5N1) Hemagglutinin and Neuraminidase PLoS ONE. 7(6): e38794.)
A与B显示为不同亚型HA与NA的进化远近程度以及每种亚型中特有的糖基化位点分布位置与分布比率。红色为该亚型中相应区域中N-糖基化位点保守率大于百分之95的位点,绿色与蓝色分别代笔保守率为95%~5%与5%以下的位点。可以看出在所有亚型HA与NA中,一共有三个N-糖基化位点高度保守。
二 N-糖基化位点在HA与NA中功能的预测(H1N1)
【本文已发表于《PLoS One 》】
本实验运用一系列生物信息学工具,第一次在 H1N1 流感病毒演化过程中糖基化位点的改变方式、规律及在病毒进化中的功能方面进行全面分析和探讨。首先使用本实验室编写的简单糖基化位点预测软件对 H1N1 流感病毒中的 2770 条 HA 全长序列和 3235 条 NA 全长序列上的潜在 N- 糖基化位点进行预测和各糖基化位点的变异和保守性分析;然后通过蛋白的同源建模(以已知三维结构的同源蛋白为模板构建未知蛋白的结构)和蛋白糖基化的计算机模拟等方法对各个潜在糖基化位点是否可以糖基化进行验证;在获得了不同宿主和不同时间段分离出的 H1N1 毒株中 HA 和 NA 上糖基化位点的数量、位置以及保守性等信息后,分析不同宿主中 H1N1 病毒演化过程中蛋白糖基化位点改变的方式、规律;通过计算机模拟蛋白糖基化的方式分析糖基化位点在病毒演化中改变的各种可能作用和功能。虽然本文中的一些结论和假设还需要实验数据的支持,这些发现可以为流感病毒的蛋白糖基化研究和病毒疫苗生产起到一定的指导作用。
不同宿主中的进化过程和宿主对 H1N1 流感病毒选择压力的强度,可以通过不同宿主中分离的 H1N1 流感病毒 HA 和 NA 上的糖基化位点模式和保守性反映出来。人、 猪和禽类流感病毒中 HA 和 NA 上糖基化位点不同的进化途径说明了这些宿主对流感病毒施加了不同的免疫压力,具有不同的免疫系统。禽体内分离到的病毒 HA 和 NA 氨基酸序列的变异性较低,糖基化位点的保守性较高,说明禽宿主体内对流感病毒的选择压力较低,这使得禽类成为理想的流感病毒贮库,禽类体内含有几乎所有类型的甲型流感病毒。研究表明,每次爆发性流感都至少部分起源于禽流感病毒,包括感染宿主范围的直接种间跨越或者间接的人和禽流感病毒部分基因的交换。
人 H1N1 流感病毒的 HA 和 NA 氨基酸序列和糖基化位点的变异性最大,说明人类对流感病毒的选择压力最大。虽然猪流感病毒 HA 和 NA 出现变异糖基化位点的位置最多,虽然偶然发生变异的糖基化位点很少在猪流行毒株中保存下来,但其高变异性使得猪流感病毒最有可能出现高致病力和传染能力的毒株,甚至会导致人类爆发性流感病毒的爆发。
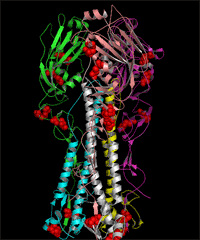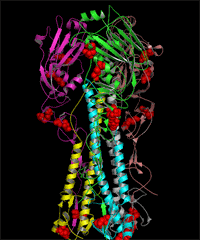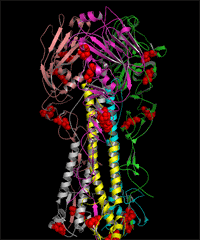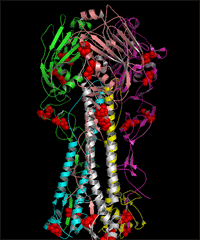
人流行性 H1N1 流感病毒连有糖链的 HA 和 NA 的 3D 结构图 (发表论文 : Sun S, Wang Q, Zhao F, Chen W, Li Z.(2011) Glycosylation site alteration in the evolution of influenza A (H1N1) viruses. PLoS One 6: e22844. )
(A) The glycans attached to glycosites 179 (A-1) and 177(A-2) of HA as well as the surrounding regions of the trimeric proteins. (B) The glycans attached to glycosites 144 (B-1), 172 (B-2) and 142(B-3) of HA as well as the surrounding regions of the trimeric proteins. (C) The glycans attached to glycosites 104 (C-1), 286 (C-2) and 71(C-3) of HA as well as the surrounding regions of the trimeric proteins. (D) The structure of the glycosylated NA tetramer from A/Singapore/6/1986 and the glycans attached to the glycosites in region C (including glycosites 146, 365 and 434). The surface of the HA proteins is shown in white. The glycosites and glycans are colored in black and green, respectively. The receptor-binding site (RBS) and the five antigenic sites of HA as well as t he enzymatic active site and antibody binding sites of NA are highlighted in the same colors as in FIG. 3C and 3D, respectively. The amino acid locations are numbered according to the HA of SC 1918 and the NA of BM 1918 numbering. The glycosites are numbered in white.
三 N-糖基化位点对病毒宿主特异性的研究(H5N1)
【本文已发表于《PLoS One 》】
相比目前常见诸报道的H7N9亚型流感病毒,H5N1亚型病毒的死亡率远远高过其他亚型(约60%在入院治疗病人中,部分地区高达100%)。该研究通过一系列分子建模、分子动力学模拟等生物信息学研究最终发现H5N1病毒HA头部的160N和171N糖基化位点显著影响了H5N1病毒的宿主特异性。
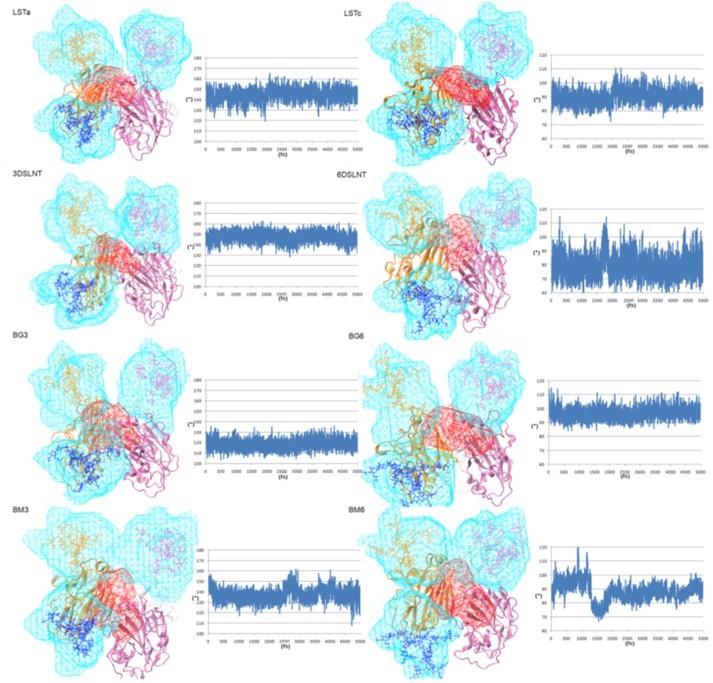
三聚体HA与唾液酸糖链复合体中的糖链的容积分析
在三聚体HA与唾液酸糖链复合体5 ns的模拟过程中,θ角度角度的稳定的变化显示唾液酸糖链末端形成的拓扑稳定性。所有的SA-α-2,3-Gal唾液酸糖链维持着线状拓扑结构(110°<θ<180°)而SA-α-2,6-Gal唾液酸糖链则维持着鱼钩状的拓扑结构(60°<θ<110°)。158N与169N糖基化位点上的N-糖链在模拟过程中发生着剧烈的摆动,相比而言复合体中唾液酸糖链则受限于RBD较小区域周围。在整个过程中SA-α-2,3-Gal唾液酸糖链剩余部分与RBD邻近亚基的169N位点上的糖链有着更多的重叠容积区域,而SA-α-2,3-Gal唾液酸糖链剩余部分则由于较小θ角度使得糖链剩余部分朝向HA三聚体轴心位置而更多地与158N位点上糖链相互作用.
陕ICP备11008824号 Copyright ©2008-2020 the Laboratory for Functional Glycomic.
Taibai Bei Road, Xi'an, Shaanxi, China, +008613572067574 QQ 8135487.E-mail: cwt@nwu.edu.cn